Реакции электрофильного присоединения
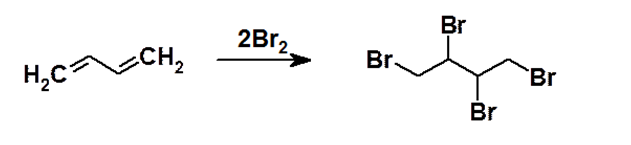
Для всех типов диенов, как и для алкенов, характерны реакции электрофильного присоединения (AE). При этом для сопряженных диенов характерны некоторые особенности протекания данного типа реакций. Коль скоро в молекуле диена присутствуют две кратные связи, то, например, бромирование бутадиена избытком брома приводит к присоединению уже не двух, а четырех атомов брома с образованием соответственно 1,2,3,4-тетрабромбутана.
Рисунок 1.
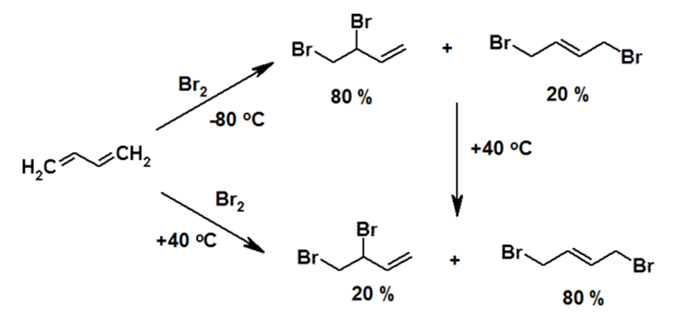
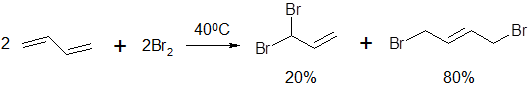
При этом в условиях использования эквимолярных количеств бутадиена и брома образуется смесь изомеров: 3,4-дибромбутен-1 и 1,4-дибромбутен-2. Соотношение количеств этих изомеров зависит от температуры реакции. В случае проведении реакции на холоде (при -80°С) основным продуктом реакции будет 3,4-дибромбутен-1, а при +40°С – 1,4-дибромбутен-2. Причем, если смесь продуктов, полученную при пониженной температуре, выдержать при +40°С, их массовое соотношение станет таким же, как если бы реакцию изначально проводили при +40°С.
Рисунок 2.
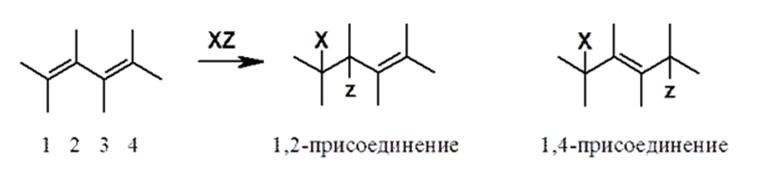
Таким образом, в ходе электрофильного присоединения к диенам реагент присоединяется не только к соседним атомам углерода, образующим кратную связь (так называемое, 1,2-присоединение), но и к концевым атомам углерода диенового форагмента (1,4-присоединение).
Рисунок 3.
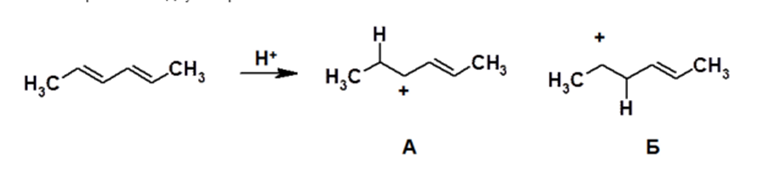
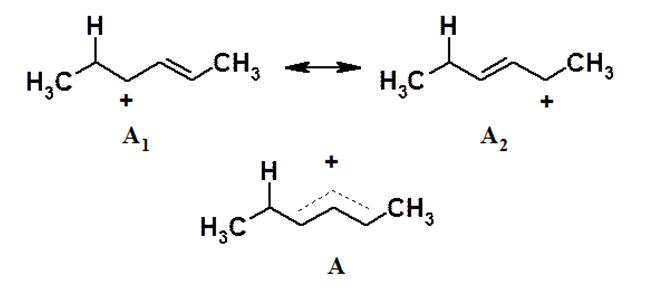
Отсюда следует, что реакции типа АЕ представляют собой двухстадийный процесс, в котором первая стадия – это присоединение электрофильной частицы с образованием наиболее стабильного карбокатиона. Атака протона по $p$-электронам диенового фрагмента теоретически может привести к двум карбокатионам типов А и Б, то есть на примере присоединения $HCl$ к гексадиену-2,4 получим:
Рисунок 4.
Оба этих катиона являются вторичными, поэтому, на первый взгляд, нельзя предсказать, какой из них более устойчив. Однако в катионе А вакантная орбиталь положительно заряженного атома углерода участвует в образовании сопряженной π-системы.
Формула катиона А, приведенная выше, не отражает реального строения образующегося катиона. На самом деле его строение отображается набором граничных структур.
Рисунок 5.
Таким образом, в реальности образующийся карбокатион имеет структуру А, в которой положительный заряд равномерно распределен между тремя углеродными атомами, что приводит к снижению энергии (т.е. увеличению стабильности) промежуточного продукта. Отсюда следует, что катион А (т.н. аллильный карбокатион) более устойчив, чем Б, благодаря делокализации положительного заряда.
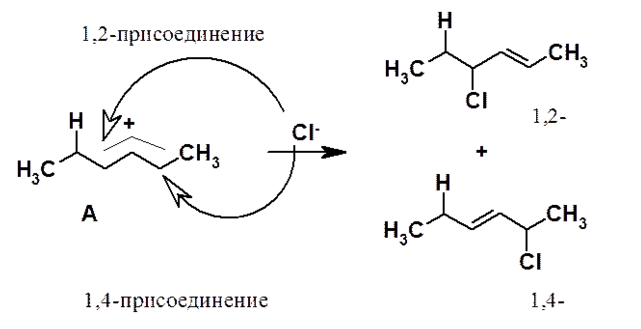
Далее анион хлора присоединяется либо ко второму, либо к четвертому углеродному атому диенового фрагмента с образованием соответственно 4-хлорбутена-2 и 2-хлорбутена-3.
Рисунок 6.
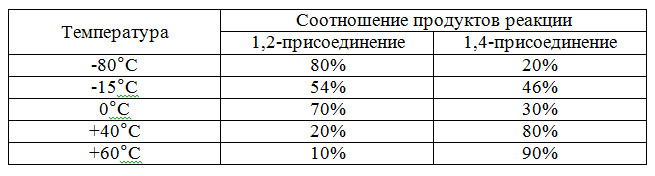
Соотношение (по массе) продуктов реакции электрофильного присоединения зависит от температуры:
Рисунок 7.
Данная смесь является равновесной, а повышенное содержание в ней 1,4-дибромбутена-2 объясняется более высокой устойчивостью промежуточного продукта - аллильного карбокатиона.
Дополнительно следует отметить, что 1,2-присоединение происходит в условиях кинетического контроля, а 1,4-присоединение – термодинамического контроля реакции электрофильного присоединения. Все эквимолярные реакции электрофильного присоединения реагента к сопряженным диенам протекают подобным образом, отличаясь лишь температурными интервалами и соотношениями продуктов 1,2- и 1,4-присоединения. При этом реакция электрофильного присоединения обратима.
Реакции гидрирования
Результат гидрирования сопряженных диенов зависит от условий проведения реакции.
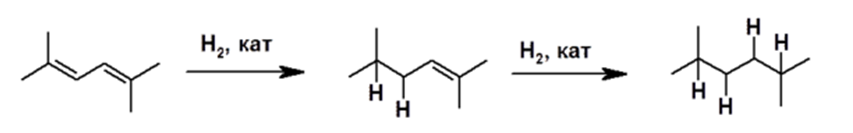
Каталитическое гидрирование всегда протекает как 1,2-процесс, приводя в конечном итоге к получению соответствующего алкана:
Рисунок 8.
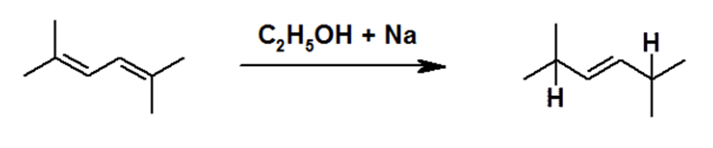
В результате гидрирования диена натрием в этаноле или в жидком аммиаке всегда происходит 1,4-присоединение водорода.
Рисунок 9.
Поскольку алкены в принципе не вступают в реакцию гидрирования, то на этом реакция останавливается и образование соответствующего алкана не происходит.
Примеры решения задач
Сколько бутадиена необходимо для получения 100 г 1,4-дибромбутена-2 при температуре 40 °С?
Решение. Соотношение продуктов реакции бромирования при данной температуре составляет 80 % 1,4-дибромбутена-2 и 20 % 3,4-дибромбутена-1:
Рисунок 10.
Отсюда масса ($m$) 3,4-дибромбутена-1 равна
$(100 г)/(80\%) \cdot 20%=25$ г
Молярная масса (M) обоих продуктов реакции ($C_4H_6Br_2$) равна 214 г/моль.
Тогда количество вещества ($ν$) 1,4-дибромбутена-2 составит
$m/M=(100 г)/(214 г/моль)=0,47$ моль
а количество 3,4-дибромбутена-1 составит
$m/M=(25 г)/(214 г/моль)=0,12$ моль
Суммарное количество продуктов реакции
$0,47 моль + 0,12 моль = 0,59 моль$
Молярная масса бутадиена равна 54 г/моль. Отсюда масса бутадиена равна
$ν \cdot M=54 г/моль \cdot 0,59 моль=31,86 г$
Какой объем водорода необходим для получения бутана из дивинила массой 100 г при нормальных условиях?
Решение. Реакция гидрирования идет по уравнению:
Молярная масса дивинила равна 54 г/моль. Отсюда количество вещества ($ν$) дивинила составляет
$ν=m/M=(100 г)/(54 г/моль)=1,85 моль$
По уравнению реакции для полного гидрирования дивинила требуется 2 моль водорода на 1 моль дивинила. Отсюда количество водорода равно
$2 \cdot 1,85 моль=3,7 моль$
Объем 1 моль газа в нормальных условиях занимает объем, равный 22,4 л. Тогда объем водорода составит
$3,7 моль \cdot 22,4 л/моль=82,88 л$