Строение многоатомных частиц
В типах гибридизации соблюдается основанный на энергетической диаграмме многоэлектронного атома порядок указания валентных орбиталей центрального атома $A$: $ns$-$np$-$nd$, где $n$ - номер периода элемента $A$.
В число гибридных орбиталей включаются орбитали центрального атома $A$, как использованные для образования связей $A-B$, так и содержащие неподеленные пары электронов; последние обозначены двумя точками в молекулярной формуле и «лепестком» в пространственном изображении. Если частица $AB_n$ является радикалом, то на гибридной орбитали вместо пары будет содержаться один электрон. Для таких частиц, в зависимости от их состава, наблюдаются следующие геометрические формы:
-
Геометрическая форма частиц $AB_n$ ($n >2$) при одинаковых атомах $B$ и при отсутствии орбиталей с неподеленными парами электронов или с неспаренными электронами классифицируется как геометрически правильная; например, такая частица с общей формулой $AB_4$ ($sp^3$) обладает формой правильного тетраэдра, т. е. значения всех углов $A-B-A$ равны $109,5^\circ$.
-
Геометрическая форма частиц $AB_n$ при разных атомах $B$ и при отсутствии орбиталей с неподеленными парами электронов или с неспаренными электронами классифицируется как геометрически искаженная; например, такая частица с общей формулой $ABC_3$ ($sp^3$) обладает формой искаженного тетраэдра т. е. значения углов $C-B-C$ и $C-B-F$ отличаются от значения $109,5^\circ$.
-
Геометрическая форма частиц $AB_n$ при наличии орбиталей с неподеленными парами электронов или с неспаренными электронами классифицируется как геометрически незавершенная; например, такая частица с общей формулой $AB_3$ ( $sp^3$ ) обладает формой незавершенного тетраэдра в отличие от частицы $AB_4$ ($sp^3$) - завершенного тетраэдра. Наличие орбиталей с неподеленными парами электронов или с неспаренными электронами всегда приводит к искажению геометрической формы.
-
В геометрических формах, отвечающих $sp^3d-$, $sp^3d^2-$ (для частиц : $AB_5$) и $sp^3d^3$- -гибридизации, аксиальные (осевые) позиции концевых атомов В отмечены звездочкой ($В^*$) в отличие от экваториальных позиций (без звездочки).
Пространственное изображение геометрических форм частиц
На схеме ниже представлены многоатомные химические частицы (молекулы, радикалы, ионы) с общей формулой $AB_n$, где $A$ - центральный атом, $B$ - концевые атомы (группы атомов, лиганды).
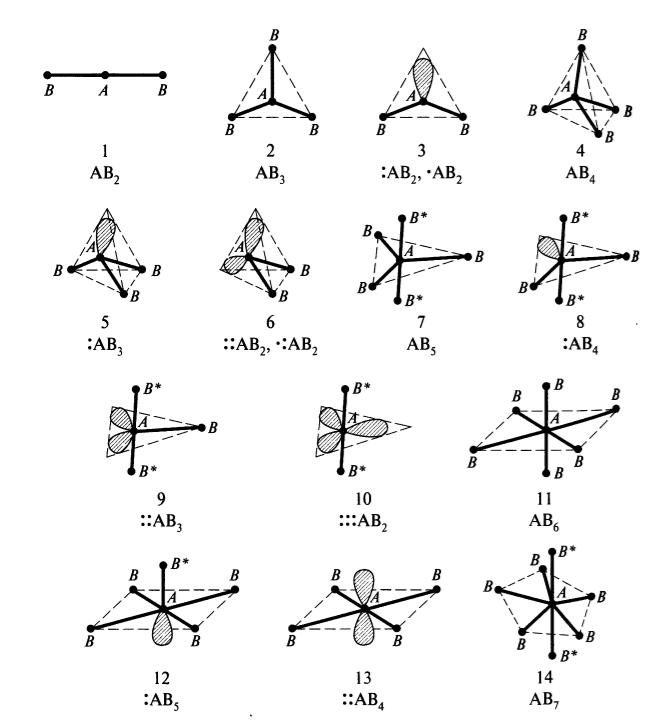
Рисунок 1. Геометрические формы частиц $AB_n$
В геометрических формах показаны, кроме химических связей $A-B$, орбитали атома $A$, содержащие пару валентных электронов (обозначение, например, $:AB$) или неспаренный электрон (обозначение $^*AB$), а также аксиальные (осевые) позиции концевых атомов $B$ (обозначение $B^*$) в отличие от экваториальных позиций (обычно связи $A-B$ и $A-B^*$ имеют разную длину).
Представлены многоатомные химические частицы (молекулы и ионы) $АmВn$, где атомы $A$ - центральные, а атомы (группы атомов, лиганды) $B$- концевые.
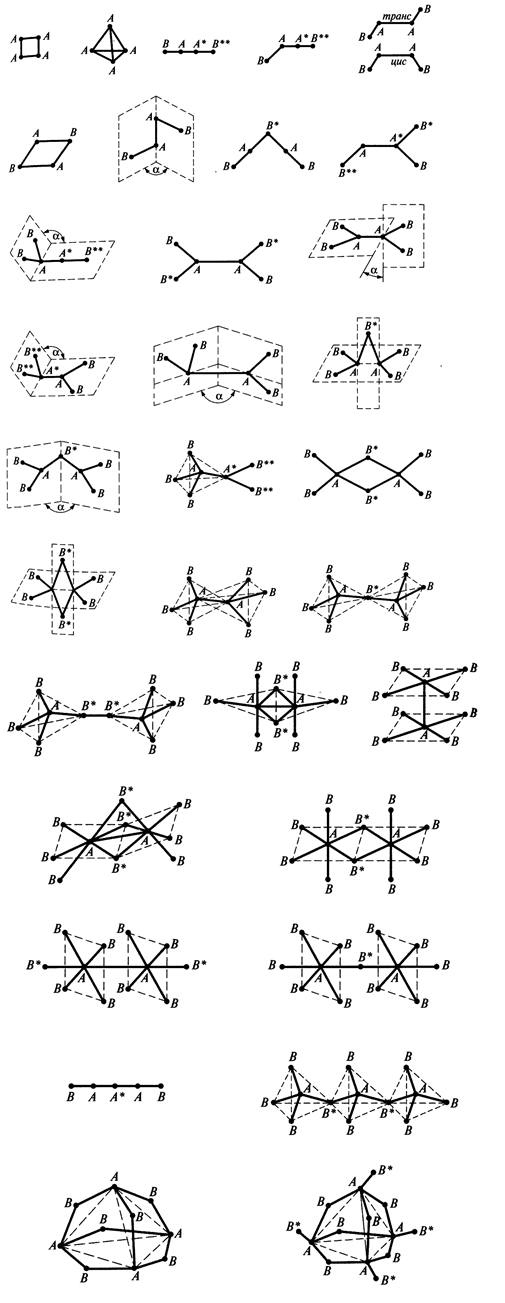
Рисунок 2. Геометрическая форма частиц с несколькими центральными атомами
В пространственном изображении геометрических форм показано расположение атомов $A$ и $B$ и все $\sigma $-связи $A-A$ и $A-B$. Символы некоторых атомов $A$ и $B$ (на изображениях) отмечены звездочками (*) для идентификаций положений этих атомов.

















