Двухатомные молекулы
При построении одноэлектронной молекулярной орбитали для молекулы водорода надо использовать линейную комбинацию атомных $s$-орбиталей изолированных атомов водорода. В этом случае атомы одинаковы и основные состояния их также одинаковы. Если молекула образована двумя разными атомами, то при образовании связи не всегда будут участвовать одинаковые орбитали обоих атомов. Например, в молекуле $HCl$ у атома водорода в образовании связи будет участвовать орбиталь $ls$, а у атома хлора $ls$-орбиталь никакого участия в образовании связи не принимает. Это обстоятельство заставляет обратить внимание на важное условие при образовании связи: для того чтобы две орбитали могли образовать прочную молекулярную орбиталь, необходимо, чтобы соответствующие им энергии имели сравнимые значения.
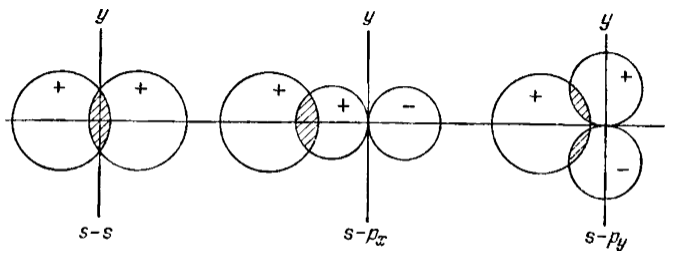
Рисунок 1. Перекрывание $s-$ и $p$-орбиталей
Гибридные орбитали хорошо соответствуют представлениям классической теории химической связи, согласно которой связь осуществляется парой электронов, локализованных между ядрами двух атомов, образующих связь.
В рамках классической структурной теории ковалентная связь характеризуется строго определенным направлением в пространстве. С другой стороны, квантово-механические расчеты приводят к каноническим орбиталям, для которых характерна высокая степень делокализованности: они не принадлежат отдельным связям, а охватывают сразу все ядра или большие группы в данной молекуле.
В приведенном примере $ls$-орбитали атома хлора соответствует гораздо меньшая энергия, чем $ls$-орбитали атома водорода, поэтому они комбинироваться не будут. Необходимо также учитывать степень перекрывания между комбинирующимися орбиталями, хотя само по себе перекрывание является недостаточным критерием для образования связи, тем не менее оно важно.
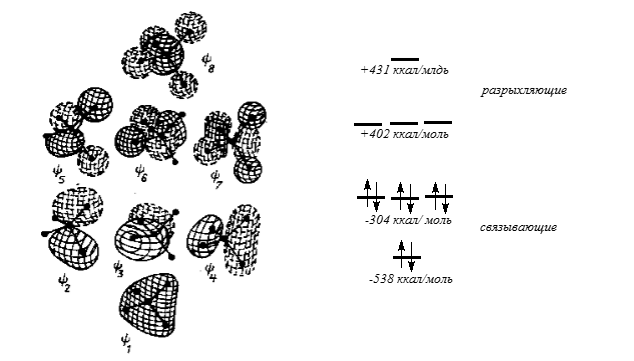
Рисунок 2. Форма канонических $MO$ молекулы $CH_4$.
Сплошные и пунктирные линии отражают разные знаки волновой функции. Приведены вычисленные значения энергии орбиталей. Знак «минус» означает выигрыш энергии при заселении орбитали электроном, а знак «плюс» - проигрыш энергии.
Молекулы с неподеленными парами: $H_2O$
Одним из наиболее выдающихся достижений квантовомеханического подхода к строению молекулы было успешное исследование молекулярной геометрии. Рассматривая связи между атомами в молекуле как результат перекрывания атомных орбиталей, следует ожидать от молекулы определенной пространственной структуры. Существует много различных путей объяснения строения молекулы. Стереохнмический метод, отличается от излагаемого здесь, но использование понятия локализованных атомных орбиталей в теории валентных связей оказалось настолько удачным, что есть смысл это обсудить.
Согласно теории валентных связей, ковалентную связь можно представить как результат спаривания двух электронов на атомных орбиталях двух разных атомов. Связь должна расположиться в направлении перекрывания атомных орбиталей. Наиболее прочная связь образуется в том месте, где возможно наибольшее перекрывание двух орбиталей. В качестве примера рассмотрим молекулу воды. В образовании связи участвуют $1s$-орбитали двух атомов водорода. Так как считается, что связь образуется посредством спаривания электронов, то, по-видимому, будут спариваться $p$ электроны.
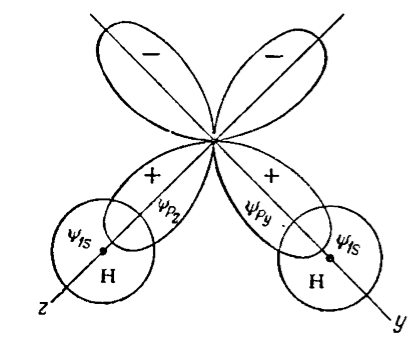
Рисунок 3. Перекрывание связывающих орбиталей в молекуле воды
На рис. 3 показана $уz$ плоскость молекулы воды, орбитали $py$ и $pz$ расположены в этой плоскости взаимно перпендикулярно. Для получения возможно большего перекрывания между $1s$-орбиталями атомов водорода и $py$ и $pz$-орбиталями атома кислорода необходимо, чтобы атомы водорода подошли к атомам кислорода вдоль осей $y$ и $z$. Это дает показанное на рисунке перекрывание, а угол $H-O-H$ должен быть равен примерно $90^\circ$. На самом деле этот угол равен $104,5^\circ$; такое отклонение от $90^\circ$ может быть вызвано отталкиванием между двумя атомами водорода, а также некоторым участием в связи $2s$-электронов атома кислорода. .
Такую же структуру, как у воды, можно ожидать у $H_2S$, $H_2Se$ и $Y_2Te$. Действительно, сходство между теорией и опытом для этих молекул вполне хорошее: угол $H-X-H$ для $H_2S$ найден равным $92,2^\circ$, для $H_2Se - 91,0^\circ$ и для $H_2Te - 89,5^\circ$.
В молекуле воды (рис. 4) из шести $MO$ занято четыре, а две верхние свободны. В отличие от $HF$, в $H_2O$ нет вырожденных уровней. Высшая занятая $MO$ является несвязывающей и локализована на атоме кислорода, это одна из «неподеленных пар». Следующая, более низкая занятая $MO$ является настолько слабо связывающей, что ее можно ассоциировать со второй неподеленной парой. Видно, что кислород обладает большей электронной плотностью, чем атомы водорода.
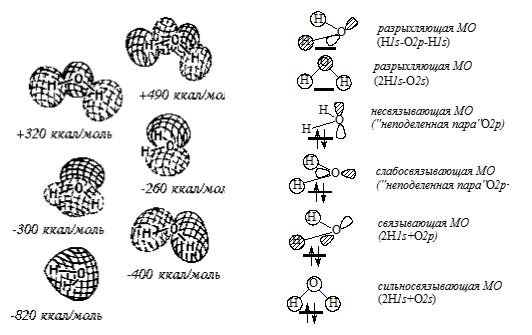
Рисунок 4. $MO$ молекулы $H_2O$
В молекуле $NH_3$ (рис. 5) имеются две вырожденыые связывающие $MO$. Высшая занятая $MO$ - очень слабо связывающая; она имеет одну долю, направленную от атомов водорода, и поэтому соответствует неподеленной паре.
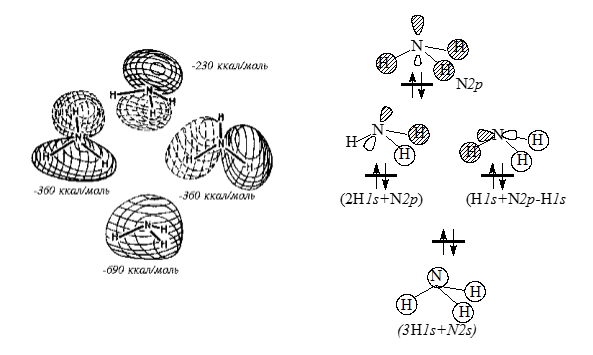
Рисунок 5. $MO$ молекулы $NH_3$

















