Окисление алканов можно осуществлять как при высоких, так и при низких температурах. Энергичное окисление этих веществ кислородом воздуха при высоких температурах, которое приводит к полному разрушению молекул алканов и образования $CO_2$ и $H_2O$, называют горением. Этот процесс имеет большое значение, поскольку он происходит во всех двигателях внутреннего сгорания и лежит в основе извлечения энергии из топлива.
Окисления насыщенных углеводородов проходит через стадию образования гидропероксидов с группой -$O-O-H$. В двигателях внутреннего сгорания углеводороды нормального строения образуют перекиси, которые вызывают преждевременное возгорание паров бензина без участия свечи зажигания. Это явление называют детонацией. Оно наносит большой вред, так как ведет к преждевременному износу двигателей, а также не дает возможности полностью использовать его мощность. Насыщенные углеводороды с разветвленной строением не детонируют. Особенно ценным в качестве моторного топлива является изооктан:
2, 2, 4-триметилпентан (изооктан)
Изооктан был положен в основу условной шкалы для оценки моторных топлив по «октановому числу». Изооктану в этой шкале было приписано октановое число 100, а н-гептану - 0. Бензины сравнивают с этой шкалой, то есть со смесью изооктана и н-гептана. Например, бензин с октановым числом 72 горит так, как смесь, которая состоит из 72\% изооктана и 28\% н-гептана.
Регулироемое окисление алканов
При обычных температурах кислород воздуха и такие окислители, как $KMnO_4$, $K_2CrO_4$, $K_2Cr_O_7$, а не окисляют насыщенные углеводороды. При невысокой температуре (\~{} 150 ${}^\circ$ С) и наличии катализаторов, например солей марганца, алканы могут окисляться с образованием различных кислородсодержащих соединений: спиртов, кетонов, кислот, оксикислот, кетонокислот тому подобное. Контролируя и регулируя процесс окисления, можно добывать только определенный продукт.
Алканы способны окисляться, как правило, при высоких температурах. Окисление алканов - это сложный, сильно экзотермический процесс, для которого характерны разрыв С-С-связей и частичное полное окисление до $CO_2$. При высоких температурах реакцию трудно регулировать, и поэтому часто применяют небольшие температуры 120-150 ${}^\circ$С и катализаторы (соли $Mn$, $V$, $Co$). Как окислители используются молекулярный кислород, перманганат и хромат калия.
Механизм окисления алканов
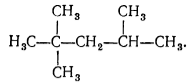
В первом приближении при высоких температурах вследствие отщепления атомов водорода от связи С-Н или при разрыве связи С-С образуются свободные радикалы $R$ , которые взаимодействуют с молекулярным кислородом с появлением перекисного радикала:
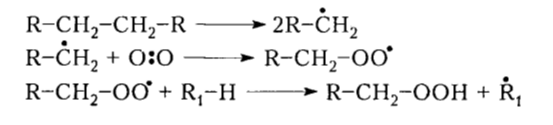
Рисунок 2. Механизм окисления алканов. Автор24 — интернет-биржа студенческих работ
Такие пероксидные радикалы отщепляют атомы водорода от других молекул алканов затем превращаются в соответствующие гидропероксиды, причем в соединениях R-H под действием перекисного радикала легче отрываются атомы водорода от третичного атома углерода, затем от вторичного, а потом уже от первичного. В условиях реакции окисления (высокие температуры и давление) образованные гидропероксиды разлагаются на свободные радикалы в зависимости от разветвленности гидропероксида по указанным ниже маршрутам, причем строение гидроперекиси определяет природу конечного продукта реакции:
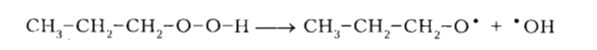
Рисунок 3. Механизм окисления алканов. Автор24 — интернет-биржа студенческих работ
Алкоксирадикалы, в свою очередь, участвуют в различных реакциях с образованием кислородсодержащих соединений (спиртов, альдегидов и т.п.) или снова алканов:
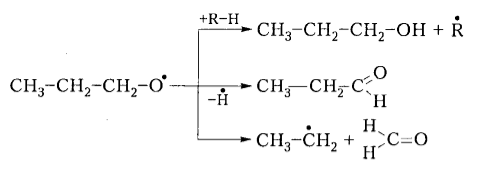
Рисунок 4. Механизм окисления алканов. Автор24 — интернет-биржа студенческих работ
Вторичные гидропероксиды образуют при окислении спирты, альдегиды и кетоны:
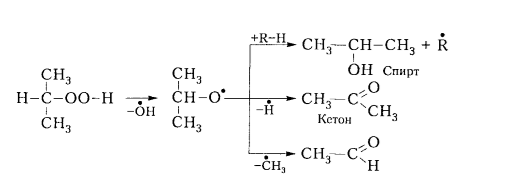
Рисунок 5. Механизм окисления алканов. Автор24 — интернет-биржа студенческих работ
Аналогично третичные гидропероксиды образуют спирты и кетоны:
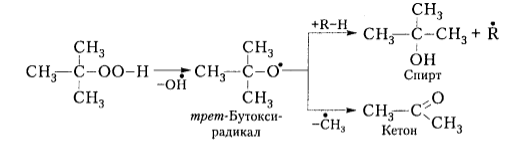
Рисунок 6. Механизм окисления алканов. Автор24 — интернет-биржа студенческих работ
Использование окисления алканов в промышленности
Получаемые окислением алканов альдегиды и первичные спирты можно дальше окислять в соответствующие кислоты:
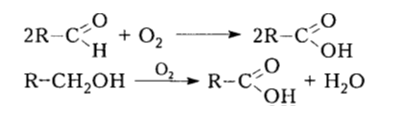
Рисунок 7. Использование окисления алканов в промышленности. Автор24 — интернет-биржа студенческих работ
Таким образом в промышленности получают синтетические жирные кислоты (СЖК) и высшие спирты (ВС) с числом углеродных атомов 10-25. При окислении бутана получают уксусную (ацетатную) кислоту:
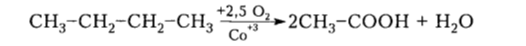
Рисунок 8. Использование окисления алканов в промышленности. Автор24 — интернет-биржа студенческих работ
В ограниченном масштабе в промышленности используют окисление высших парафинов кислородом воздуха при 100 -- 150${}^\circ$С в присутствии ацетата марганца как катализатора. Окисление происходит при продувании тока воздуха через расплавленный парафин, содержащий соль марганца. В результате разрыва углерод-углеродной связи образуется сложная смесь кислот с нормальной цепью:
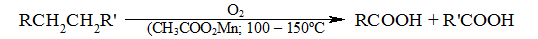
Рисунок 9. Использование окисления алканов в промышленности. Автор24 — интернет-биржа студенческих работ
Кислоты отделяют от непрореагировавшего парафина растворением в водной щелочи с последующей нейтрализацией минеральной кислотой. Разновидностью этого метода является один из промышленных способов получения уксусной кислоты окислительной деструкцией $н$-бутана:
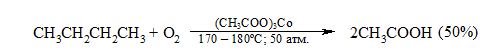
Рисунок 10. Использование окисления алканов в промышленности. Автор24 — интернет-биржа студенческих работ
При каталитическом окислении высших парафинов нормального строения ($C_{12}-C_{25}$) в промышленности добывают высшие жирные кислоты и высшие жирные спирты. Высшие жирные кислоты используют для получения синтетических моющих средств, а высшие жирные спирты - для извлечения пластификаторов пластических масс.
Из пропана и метана в промышленности получают уксусный альдегид, метанол и муравьиный альдегид. Окисление метана кислородом воздуха при нормальном давлении дает муравьиный альдегид, а если окисления метана вести при давлении $151,5\cdot 10^5$ Па и 400 ${}^\circ$С, то главным продуктом такого процесса является метиловый спирт.
Бутан окисляют в уксусную кислоту в присутствии солей Со. Для производства мыла окисляют выше парафины нефти.
Процессы окисления играют важную роль в микробиологическом преобразовании алканов в питательные вещества с применением бактерий и дрожжей. Легче превращаются неразветвленные алканы.

















