Электронная конфигурация атома
Электронная конфигурация атома - это запись распределения электронов в его атомах по оболочкам и подоболочкам. Химические свойства элемента зависят главным образом от строения электронной оболочки атома и от числа электронов на внешнем (валентном) слое. Электронная конфигурация обычно записывается для атомов в их основном состоянии. Для определения конкретной конфигурации атома в основном состоянии существуют три основных правила.
Правила Клечковского. Электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
1-е правило Клечковского: орбитали заполняются по мере увеличения сумм главного и орбитального квантовых чисел $n + l$.
2-е правило Клечковского: при одинаковых значениях суммы $n + l$ орбитали заполняются по мере увеличения главного квантового числа.
Принцип запрета Паули – на одной орбитали не может быть двух электронов с совпадающими квантовыми числами. То есть на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины. Принято обозначать спин $+1/2$ стрелкой, направленной вверх, а спин $-1/2$ – стрелкой, направленной вниз.
Правило Хунда – суммарный спин атома в $s-, p-, d-$ и других подоболочках должен быть максимальным. Другими словами, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами и лишь после того, как одиночные электроны займут все орбитали, происходит их окончательное заполнение оставшимися электронами с противоположными спинами.
Правилу Хунда отвечает минимум энергии атома. Такое состояние атома называется основным. Распределение электронов в атомах, которое приводится в таблице Периодической системы Д.И. Менделеева, отвечает основному состоянию атома. При других размещениях в атоме электроны будут находиться в возбужденном состоянии с более высокой энергией.
Примеры решения типовых задач на составление электронной конфигурации атома
Обосновать электронную конфигурацию атома водорода.
Решение. Атом водорода имеет атомный номер $1$, следовательно количество электронов в атоме – $1$. Этот единственный электрон должен занимать $s$-орбиталь $К$-оболочки, поскольку она имеет самую низкую энергию. Таким образом, электронная конфигурация атома водорода $1s^1$ (индекс $1$ указывает на число электронов, занимающих орбиталь $1s$).
Обосновать электронную конфигурацию атома лития.
Решение. Атомный номер лития – $3$, количество электронов – $3$. Орбиталь с самой низкой энергией – это $1s$-орбиталь. Согласно принципу запрета Паули, она может принять только два электрона, причем имеющие разные спиновые квантовые числа. Третий электрон в атоме лития должен занимать орбиталь, следующую по энергии за самой низкой $1s$-орбиталью, т.е. $2s$-орбиталь. Таким образом, литий имеет конфигурацию $1s^22s^1$.
Записать и изобразить графически электронную конфигу-рацию атома азота.
Решение. Азот имеет атомный номер $7$, следовательно, в атоме азота содержится $7$ электронов, а его электронная конфигурация записывается как $1s^22s^22p^3$. Три электрона. Находящиеся на $2р$-оболочке, должны располагаться поочередно на каждой из трех $2р$-орбиталей. При этом все три электрона должны иметь параллельные спины.
Графически это изображается как:
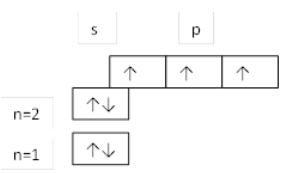
Рисунок 1.
Написать электронную формулу атома углерода в основ-ном и возбужденном состоянии.
Решение. Электронная формула атома углерода в основном состоянии $1s^22s^22p^2$. В возбужденном состоянии один из электронов из $2s$-подоболочки переходит на $2р$-уровень с образованием конфигурации $1s^22s^12p^3$. Такой переход сопровождается затратой энергии, но при образовании соединений четырехвалентного углерода эта затрата компенсируется выигрышем по энергии при образовании четырех связей.
Молекулярные орбитали
Заполнение молекулярных орбиталей $(МО)$ электронами происходит по тем же принципам, что и заполнение атомных орбиталей: на каждой молекулярной орбитали может находиться один или два электрона, причем с противоположными спинами. Существуют $МО$ трех типов: связывающие, несвязывающие и разрыхляющие.
Связывающие орбитали образуются в результате перекрывания (наложения) атомных орбиталей двух соседних атомов. В свою очередь, связывающие орбитали подразделяются на $\sigma$-орбитали («сигма») и $\pi$-орбитали («пи»), соответствующие $\sigma$- и $\pi$-связям. Образование $\sigma$-связи происходит в результате лобового перекрывания между атомными орбиталями следующих типов:
-
двух $s$-орбиталей (рис. 1 а);
-
двух $р$-орбиталей, ориентированных вдоль одной оси (рис. 1 а);
-
одной $s$-орбитали и одной $р$-орбитали, ориентированной в сторону $s$-орбитали.
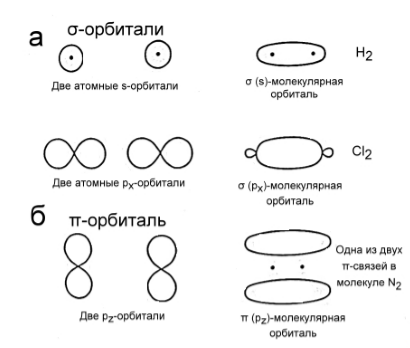
Рисунок 2. Схематическое изображение связывающих орбиталей
Образование $\pi$-связи происходит в результате бокового (двойного) перекрывания $р$-орбиталей двух атомов (рис. 1 б). Такая связь возникает только в том случае, если между атомами уже существует $\sigma$-связь.
Несвязывающие орбитали – это орбитали, на которых находятся неподеленные пары, т. е. не участвующие в образовании связей, электроны. Классическими примерами атомов, содержащих неподеленные пары электронов, являются кислород и азот.
Разрыхляющие орбитали. Каждая $\sigma$- или $\pi$-орбиталь состоит из двух перекрывающихся атомных орбиталей. Электроны на таких орбиталях связывают атомы в молекулу. Но электроны могут находиться и на других орбиталях, где они способствуют разрушению молекулы. Подобные орбитали называются разрыхляющими. Для их обозначения используется знак $«*»$, например, разрыхляющая $\sigma$-орбиталь обозначается $\sigma*$. Разрыхляющая орбиталь имеет более высокую энергию, чем соответствующая ей (однотипная) связывающая орбиталь. Поэтому разрыхляющие орбитали заселяются электронами в последнюю очередь.
Гибридные атомные орбитали
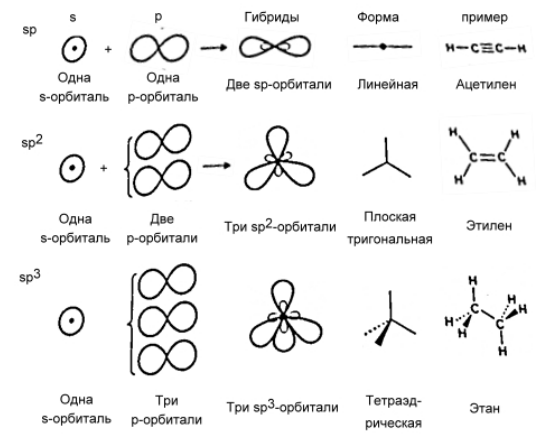
Рисунок 3. Гибридные атомные орбитали
Атомные орбитали, принимающие участие в образовании ковалентных связей, способны образовывать гибридные атомные орбитали. Особенно это характерно для молекул органических соединений. На рисунке 2 показана форма гибридных атомных орбиталей трех типов, образованных из $s-$ и $р$-орбиталей. При смешивании одной $s-$ и одной $р$-орбитали получаются две гибридные $sp$-орбитали. При смешивании одной $s-$ и двух $р$-орбиталей образуется $sp^2$-гибридная орбиталь и т.д. Гибридные орбитали из одного набора эквивалентны: из нельзя отличить друг от друга по форме или по энергии, они различаются лишь ориентацией в пространстве.
Метод молекулярных орбиталей
Молекулярные орбитали могут быть получены как линейная комбинация атомных орбиталей. Такая комбинация проводит к образованию связи, если энергии атомных орбиталей сравнимы по величине, зарядовые облака атомных орбиталей перекрываются, а исходные атомные орбитали обладают одинаковыми свойствами симметрии относительно оси молекулы.
Если на молекулярных орбиталях имеются неспаренные электроны, то молекула парамагнитна, если все электроны спарены – диамагнитна. Порядок связи определяется как полуразность числа связывающих и разрыхляющих электронов. Например, в молекулярном ионе водорода порядок связи равен $½$ (рис.3).
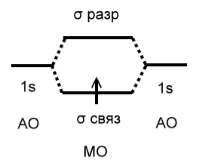
Рисунок 4. Энершетическая диаграмма $H_2^+$
Примеры решения типовых задач на составление энергетических диаграмм молекул
Составить энергетическую диаграмму молекулы $В_2$. Определить порядок связи и магнитные свойства.
Решение. Энергетическая диаграмма $В_2$ должна включать $МО$, обра-зованные из $2s-$ и $2p$-уровней изолированных атомов бора (рис. 4). По правилу Хунда происходит заполнение $\pi$-связывающих уровней, так что молекула парамагнитна; порядок связи – единица.
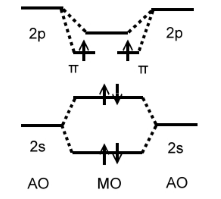
Рисунок 5. Энергетическая диаграмма $B_2$
На какую атомную орбиталь – бора или хлора – будут походить молекулярные орбитали молекулы $BCl_3$?
Решение. Ввиду большей электроотрицательности хлора электроны от атома бора перейдут на молекулярные орбитали, энергия которых будет ближе к энергиям атомных орбиталей атомов хлора.


















